- Home
- 大学, 理窓 2023年1月号
- 副作用の少ない制がん剤の創製を目指す
副作用の少ない制がん剤の創製を目指す
- 2023/1/1
- 大学, 理窓 2023年1月号

研究室紹介
私は、1997年に本学薬学部薬学科を卒業後、本学で修士・博士、ポスドク、助教を経て、2012年に髙澤研究室を発足させました。
近年、がん治療において、抗がん剤耐性がん細胞にも高い効果を示し、かつ、がん細胞に特異的に作用する新たな作用機序による治療薬の開発が求められています。がん細胞では、正常細胞に比べて非常に高い増殖能がみられたり、アポトーシスが抑制されることによって生存が維持されてしまっていたりします。本研究室では、そのようながん細胞の生存および増殖の維持に重要な役割をもち、がん細胞で高発現しているタンパク質、すなわち、がん細胞において生存能を高めるためにアポトーシス抑制に働くタンパク質や、増殖能を亢進させるためにエネルギー代謝を変化させることに寄与するタンパク質を標的とし、in silico創薬手法と生化学的実験手法を用いて、新規制がん剤の創製を目指して研究を行っています。
研究例1
がん細胞特異的なエネルギー代謝にかかわる酵素
GlyoxalaseⅠ(GLOI)阻害剤の創製
 多くのがん細胞では、酸素が十分に供給されている状態でもミトコンドリアにおける酸化的リン酸化が行われず、細胞質における嫌気性解糖(解糖系)が顕著に亢進しているという現象がみられます(Warburg効果)。その一方で、解糖系では代謝副産物として細胞に有害なMethylglyoxal(MG)が生成され、その過剰な蓄積はタンパク質、DNA、RNAを非可逆的に修飾してアポトーシスを誘発します。このMGを細胞内で無毒化するシステムの律速酵素がGLOⅠです。
多くのがん細胞では、酸素が十分に供給されている状態でもミトコンドリアにおける酸化的リン酸化が行われず、細胞質における嫌気性解糖(解糖系)が顕著に亢進しているという現象がみられます(Warburg効果)。その一方で、解糖系では代謝副産物として細胞に有害なMethylglyoxal(MG)が生成され、その過剰な蓄積はタンパク質、DNA、RNAを非可逆的に修飾してアポトーシスを誘発します。このMGを細胞内で無毒化するシステムの律速酵素がGLOⅠです。
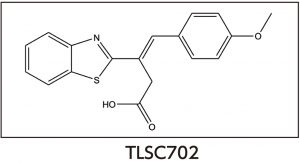
GLOⅠ は、肺がん、乳がん、膵臓がん、肝臓がん、胃がん、大腸がんなどさまざまながんで高発現がみられています。さらに、抗がん剤耐性培養がん細胞株においても高発現が報告されています。このような知見から、GLOⅠ阻害剤は、MG蓄積によってがん細胞特異的にアポトーシスを誘導するという新しい作用機序による制がん剤として期待されます。私たちは、GLOⅠをターゲットとしてこれまでに数種の天然有機化合物を見出し、それらに基づいたファーマコフォアを用いて新規GLOⅠ阻害化合物TLSC702を見出しています。現在、これらの阻害化合物についてさらなる構造最適化を行うことによって、動物実験レベルでも有用性が認められる制がん剤リード化合物の創製を目指しています。
研究例2
内在性アポトーシス阻害タンパク質XIAP
阻害剤の創製
XIAPは、アポトーシスの開始に働く酵素であるcaspase-9と、アポトーシスの実行に働くcaspase-3,-7に結合して阻害することでアポトーシスを阻害するタンパク質で、さまざまながん細胞で高発現が報告されています。細胞には、XIAPとcaspaseの結合を阻害することでXIAPによるアポトーシス阻害を解除する因子であるSmacも存在します。私たちは、このSmacのXIAPへの結合を模倣する低分子化合物の創製を目指し、結合に関わる4残基ペプチドに基づいた構造最適化の研究を行っています。また、XIAPのタンパク質量を減少させる化合物に着目し、XIAPを減少させ、かつXIAPのSmac結合部位への結合能ももち、培養肺がん細胞のアポトーシス感受性を高める化合物としてトロポロン誘導体であるβ-ツヤプリシンを見出しました。現在、トロポロン誘導体の中から、XIAPの量の減少とSmac結合部位への結合という2つの作用をもつ新規XIAP阻害化合物が見出せることを期待して、構造活性相関解析を進めています。
| 卒業生コメント 宮𥔎 夏希 株式会社アインファーマシーズ(薬・薬2022) 研究室では、抗がん作用が期待されるGLOⅠ 阻害作用をもつ化合物に着目し、培養がん細胞を用いてその効果の検討を行いました。薬局薬剤師として実臨床の現場で仕事をしていく中で、研究室生活で培った探究心や思考力、自主性が大いに役立っていると感じています。 |











