- Home
- 大学, 理窓 2022年1月号
- 基礎研究を推し進める東京理科大学の優れた研究所を訪ねて(第7回) 研究推進機構 生命医学研究所(2)【がん生物学部門編】
基礎研究を推し進める東京理科大学の優れた研究所を訪ねて(第7回) 研究推進機構 生命医学研究所(2)【がん生物学部門編】
- 2022/1/1
- 大学, 理窓 2022年1月号

今回は生命医学研究所のがん生物学部門を訪問し研究科長の北村大介教授と昆俊亮講師にお話を伺った。
【がん生物学部門のミッション】
がん細胞は正常細胞から遺伝子変異により生じ、異常増殖、浸潤・転移能という特性を持ちます。また、がん細胞は周囲の正常細胞や免疫系によって影響を受けます。当部門ではこうした異常細胞と正常細胞からなる細胞社会における、細胞の増殖、分化、遺伝子や代謝の制御の仕組みを解明することを目標としています。
 ◇北村大介 研究室
◇北村大介 研究室
北村はケルン大学に留学中の1991年に日本人として初めて遺伝子標的破壊マウスの作製に成功した。その後、九州大学に戻り、1995年に生命医科学研究所の教授に就任した。当初より一貫して、免疫学、とりわけリンパ球B細胞の分化と免疫応答の研究を行ってきた。B細胞は体内で病原体などの抗原を認識すると、クローンとして増殖し、形質細胞に分化して抗体を産生する。同時に同じクローンから記憶細胞が形成される。例えば、新型コロナウィルスのワクチン接種の後、数ヶ月を経ると抗体価が減少して感染防御効果が減弱するが、感染しても重症化しないのはこの「免疫記憶」がウィルスを排除するおかげである。これまで、抗原に反応したB細胞が形質細胞や記憶細胞に分化するためのシグナルや細胞内メカニズムについて研究してきた。また、アレルギーを引き起こすIgE抗体の産生の制御機構についても研究している。
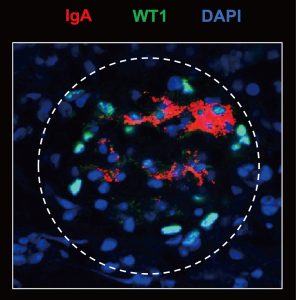
さらに、近年はIgA腎症の発病機構の研究に注力している。IgA腎症はわが国の慢性糸球体腎炎の約半数を占め、その約40%がいずれ腎不全に陥るという重要な腎疾患である。腎糸球体に選択的にIgA抗体が沈着することが原因であるが、なぜそこにIgAが沈着するのか、また、そのIgAはどうして作られるのかといった根本的な病因が不明である。北村らは順天堂大学腎臓内科と共同で、IgA腎症のモデルマウスを用いてこれらの問題の解明に取り組んでいる。これまでに、このマウスの血液中のIgAや腎臓に蓄積する形質細胞から産生されたIgAが、腎糸球体に存在するある自己抗原を認識して結合することを発見した。また、一部のIgA腎症患者の血中IgAも同じ自己抗原に結合した。つまり、IgA腎症が抗原特異的な自己免疫疾患であることを初めて見出した。この発見をもとに、IgA腎症の予防や治療方法の開発に向けて研究を進めていく。また、この自己抗原をマーカーとしてIgA腎症の早期発見のための診断法も開発する。
 ◇昆 俊亮 研究室
◇昆 俊亮 研究室
がんは、一つの上皮細胞が何かしらの遺伝子に変異が生じることから始まる。一説には、1日に数千個のがん変異細胞が体内で産生されていると言われており、このようながん予備軍とも言うべき細胞をいかにして早期の段階で排除すべきかが今後大きな課題になっていくと考えられる。我々の研究を含めた最近の研究成果より、がん変異細胞が上皮細胞層に偶発的に産生されたとき、この変異細胞と隣接する正常上皮細胞との間で互いに生存を争う細胞競合という生命現象が惹起され、その結果がん変異細胞は上皮層より排除されることが分かってきている。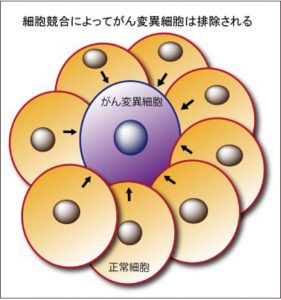 具体的には、がん変異細胞を取り囲む周辺の正常細胞が、変異細胞を管腔側へと押し出すようにして排除する(図)。管腔へと排除された変異細胞は、細胞死し、体外へと排出される運命にあるので、細胞競合とは正常上皮細胞が担っている抗腫瘍機能として近年大変注目を浴びている。私たちの研究室では、この細胞競合を制御する分子論的メカニズムを解明すべく、培養細胞や細胞競合マウスモデルを用いて精力的に細胞競合研究を進めている。また、細胞競合の機能を人為的に変容させると、本来管腔へと排除されるべきがん変異細胞が組織内へと浸潤するようになること、さらには上皮細胞の分化度の違いによって、細胞競合による排除効率が大きく異なることをこれまでの研究成果より明らかになりつつある。これらの現象を説明できる分子基盤の解明にも現在取り組んでいる。将来的には、これらの研究成果を基に、細胞競合現象を応用してがん変異細胞を早期の段階より駆逐するといった、これまでにないような新たな制がん法の確立へと昇華していきたいと思っている。
具体的には、がん変異細胞を取り囲む周辺の正常細胞が、変異細胞を管腔側へと押し出すようにして排除する(図)。管腔へと排除された変異細胞は、細胞死し、体外へと排出される運命にあるので、細胞競合とは正常上皮細胞が担っている抗腫瘍機能として近年大変注目を浴びている。私たちの研究室では、この細胞競合を制御する分子論的メカニズムを解明すべく、培養細胞や細胞競合マウスモデルを用いて精力的に細胞競合研究を進めている。また、細胞競合の機能を人為的に変容させると、本来管腔へと排除されるべきがん変異細胞が組織内へと浸潤するようになること、さらには上皮細胞の分化度の違いによって、細胞競合による排除効率が大きく異なることをこれまでの研究成果より明らかになりつつある。これらの現象を説明できる分子基盤の解明にも現在取り組んでいる。将来的には、これらの研究成果を基に、細胞競合現象を応用してがん変異細胞を早期の段階より駆逐するといった、これまでにないような新たな制がん法の確立へと昇華していきたいと思っている。
取材記 : がん細胞は周囲の正常細胞や免疫系によって影響を受ける。この仕組みを解明することで、医学や医療系に大きな発展があると確信して、研究所を後にした。